epigenética
La epigenética (del griego epi, en o sobre, y -genética) hace referencia al estudio de los factores que, sin corresponderse a elementos de la genética clásica, básicamente los genes, juegan un papel muy importante en la genética moderna interaccionando con estos primeros. Estos factores genéticos que son determinados por el ambiente celular en lugar de por la herencia, intervienen en la determinación de la ontogenia (desarrollo de un organismo, desde la fecundación del cigoto en la reproducción sexual hasta su senescencia, pasando por la forma adulta) y que igualmente interviene en la regulación heredable de la expresión génica sin cambio en la secuencia de nucleótidos. Se puede decir que la epigenética es el conjunto de reacciones químicas y demás procesos que modifican la actividad del ADN pero sin alterar su secuencia. Considerar las marcas epigenéticas como factores no genéticos nos alejaría de la verdadera visión de la disciplina científica. Las marcas epigenéticas no son genes, pero la genética moderna nos enseña que no sólo los genes influyen en la genética de los organismos.
El término fue acuñado por Conrad Hal Waddington en 1942 para referirse al estudio de las interacciones entre genes y ambiente que se producen en los organismos.
Tras la finalización del Proyecto Genoma Humano en el 2003,3 los científicos se han dado cuenta de que hay mucho más en las bases moleculares del funcionamiento celular, el desarrollo, el envejecimiento y muchas enfermedades. La idea que se tenía hace pocos años de que los seres humanos y los demás organismos son sólo fundamentalmente lo que está escrito en nuestros genes desde su concepción, está cambiando a pasos agigantados, y la ciencia avanza para lograr descifrar el lenguaje que codifica pequeñas modificaciones químicas capaces de regular la expresión de multitud de genes.
La epigenética reinterpreta conceptos conocidos y desvela nuevos mecanismos mediante los cuales la información contenida en el ADN de cada individuo es traducida. Concepto a concepto, se está descifrando un nuevo lenguaje del genoma e introduciendo la noción de que nuestras propias experiencias pueden marcar nuestro material genético de una forma hasta ahora desconocida, y que estas marcas pueden ser transmitidas a generaciones futuras. Hasta hoy se han podido discernir mecanismos epigenéticos en una gran variedad de procesos fisiológicos y patológicos que incluyen por ejemplo varios tipos de cáncer, patologías cardiovasculares, neurológicas, reproductivas e inmunes.
Aplicaciones del término. Dependiendo de la disciplina biológica, el término "epigenética" tiene diversos significados:
- En genética del desarrollo, la epigenética hace referencia a los mecanismos de regulación genética que no implican cambios en las secuencias de ADN;
- En biología del desarrollo, el término "epigenética" hace referencia a la dependencia contextual de los procesos embriológicos. El contexto incluye factores epigenéticos tanto internos (materiales maternos, propiedades genéricas físicas y autoorganizativas de las células y los tejidos, procesos de regulación genética, dinámica celular y tisular) como externos (temperatura, humedad, luz, radiación, etc.);
- En biología evolutiva, la denominación herencia epigenética engloba a los mecanismos de herencia no genéticos;
- En genética de poblaciones se emplea la expresión variación epigenética para denominar a la variación fenotípica que resulta de diferentes condiciones ambientales (norma de reacción). Los cambios epigenéticos son cambios reversibles de ADN que hacen que unos genes se expresen o no dependiendo de condiciones exteriores (polifenismo).
- En la prevención del cáncer, En los últimos años se han desarrollado tecnologías que permiten prever el comportamiento de los genes, y la industria farmacéutica ha mostrado un enorme interés en el desarrollo de fármacos que controlen dichos cambios epigenéticos. Los ensayos clínicos en marcha se centran fundamentalmente en el cáncer, pues está comprobado que factores epigenéticos juegan un papel clave en el desarrollo de los tumores.
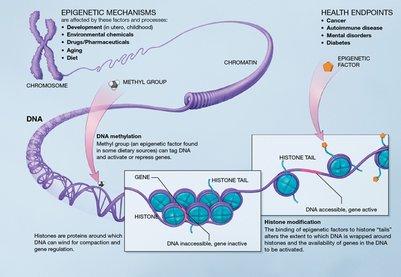
La regulación epigenética se puede dar por cambios en la conformación de la cromatina según la interacción de ésta con las histonas. Este es un nivel clave de regulación ya que el estado en el que se encuentre la cromatina determina el momento, el lugar y la forma en que un gen puede ser expresado o no. Si la cromatina se encuentra en un alto grado de condensación, los elementos de transcripción no pueden acceder a dicha región del ADN y, por lo tanto, el gen no se transcribe; es decir el gen es silenciado. En contraste, si la cromatina no se encuentra condensada, los activadores de transcripción se pueden unir a las regiones promotoras para que ocurra la transcripción del gen. Ésta es una de las formas en que se da la regulación del genoma. Se ha determinado que hay tres procesos epigenéticos de regulación: metilación del ADN, modificación de las histonas y por último el efecto de los ARN pequeños no codificantes.
Genética del desarrollo. La estructura molecular interna de los cromosomas se ha dividido en 3 capas:
- Genes codificadores de proteínas: Los que se conocen como los únicos depósitos de la herencia;
- Genes no codificadores: Cumplen una función destacada pues, a la par que las histonas, las señales químicas unidas al ADN forman la cromatina; resultan importantes para la herencia y para el desarrollo de las enfermedades y dan lugar a cadenas activas de ARN, las mismas que alteran el comportamiento de los genes codificadores;
- Capa epigenética de la información: Resulta crucial para el desarrollo, el crecimiento, el envejecimiento y el cáncer. No altera la secuencia de ADN aunque influye en su expresión. Los mecanismos epigenéticos pueden integrar señales genómicas y ambientales para controlar el desarrollo de un fenotipo particular, por lo que están íntimamente ligados con la plasticidad fenotípica y la salud.7
Las variaciones epigenéticas controlan la actividad de los genes; si es alta la concentración de sustancia "X", la actividad será alta. El código epigenético está constituido por un sistema de moléculas unidas al ADN o a las histonas, un código de las histonas es el que gobierna la expresión de los genes pues sus colas proteicas (las de las histonas) catalizan una gran variedad de adiciones químicas, como los acetilos que amplifican genes vecinos.
Mecanismos epigenéticos de regulación génica
Mecanismos epigenéticos. Metilación del ADN. Artículo principal: Metilación. Se ha descubierto que en organismos superiores, a la base citosina se le añade un grupo metilo el cual permite la conformación cerrada de la cromatina. Por lo tanto un alto grado de metilación se asocia con el silenciamiento de genes. Una forma de controlar el grado de metilación es por medio de acción de efectos ambientales. En los mamíferos se ha visto que la metionina, la colina, el ácido fólico y las piridoxinas (que son sustancias provenientes de la dieta) tienen como función la adición de grupos metilos. Por lo general la metilación se da en mayor grado en las islas CpG (regiones con alta concentración de citosina y guanina) las cuales forman parte de la región promotora de los genes. Para que la metilación se produzca de forma adecuada necesita de la ADN metiltransferasa, la cual se encarga de establecer y mantener los patrones de metilación y necesita de las proteínas de unión metil-CpG las cuales están involucradas en hacer las marcas de metilación. Un ejemplo de la importancia del silenciamiento de un gen o grupo de genes es la inactivación del cromosoma X y la impronta de genes. La impronta de genes hace referencia a que una de las copias de genes (puede ser tanto la copia materna o paterna) que se hereda de los padres, puede encontrarse completamente silenciada con el fin de tener una expresión monoalélica de ciertos genes. Por lo tanto, se observará un patrón de metilación correspondiente al sexo. Si existen anomalías en el silenciamiento de ciertas copias se pueden dar cambios en el fenotipo que pueden ser resultado de enfermedades como el caso del síndrome de Beckwith Wiedemann. Este síndrome se da cuando las dos copias del gen IGF2 están activas, es decir el proceso de impronta génica no se dio de forma adecuada al no silenciar la copia materna, y por lo tanto el individuo se caracteriza por la presencia de un alto número de tumores de gran tamaño. Se ha determinado que un alto índice de metilación de genes reguladores del ciclo celular y reparadores de ADN lleva a una mayor frecuencia de la formación de tumores. De igual forma si hay una bajo nivel de metilación (hipometilación) también se presentan enfermedades. Estudios recientes han demostrado que la metilación es un mecanismo de defensa contra virus y parásitos para evitar que éstos logren dañar el ADN.
Metilación del DNA en el cáncer. La metilación del DNA es un regulador muy importante en la transcripción de los genes. Un cuerpo muy grande de evidencias ha demostrado que la metilación aberrante del ADN está asociada con el silenciamiento no programado de los genes y los genes que tienen niveles muy altos de 5-metilcitosina en su región promotora son transcripcionalmente silenciados. La metilación del ADN es esencial en el desarrollo embrionario, y en las células somáticas, los patrones de metilación del ADN son, en general, transmitidos a las células hijas con gran fidelidad. Los patrones aberrantes de metilación del ADN han sido asociados con un gran número de enfermedades del ser humano y se han encontrado de dos maneras distintas: hipermetilación e hipometilación, comparado con los estándares normales. La hipermetilación es una de las mayores modificaciones epigenéticas responsable de reprimir la transcripción vía región promotora de los genes supresores de tumores. La hipermetilación ocurre en las islas CpG de la región promotora y está asociada con la inactivación del gen. La hipometilación también ha sido implicada en el desarrollo y progresión del cáncer a través de diferentes mecanismos.
Modificación de histonasLa cromatina está conformada por una unidad básica, el nucleosoma, conformado por histonas (H2A, H2B, H3 y H4) unidas a proteínas no histónicas. En el nucleosoma se enrolla el ADN. Por modificaciones post-traduccionales se puede modificar la configuración de las histonas. Las histonas sufren modificaciones por medio de procesos de acetilación, fosforilación, metilación, deaminación, isomerización de prolinas y ubiquitinización. Combinaciones específicas en la modificación de las histonas sirven como una especie de código que determina si el gen ha de ser silenciado o expresado y esta es otra forma de cómo se puede dar la regulación génica. Histonas.
ARN no codificanteUna forma de regulación génica es por medio de los ARN de interferencia (iARN) los cuales no codifican para una proteína en específico pero sus secuencias son complementarias a ADN o ARN codificante e impiden su traducción, esta es una forma de regulación negativa de la expresión a nivel post-transcripcional. Uno de estos tipos de ARN son los micro ARN de interferencia (miARN) los cuales se unen a secuencias complementarias y degradan dicho transcrito impidiendo así que se dé la traducción a proteínas. Se ha visto la importancia de este tipo de regulación génica en varios escenarios como: regulación en producción de tumores, efectos del envejecimiento por cambios en la metilación, asociado al estrés por metilación en genes neurales, involucrado en imperfección del desarrollo fetal entre otros.
Todos estos mecanismos epigenéticos juegan un papel fundamental en el correcto desarrollo y funcionamiento del organismo, como es el caso del desarrollo embrionario, el comportamiento o la diferenciación celular, que si se descontrola puede conducir a cáncer. La epigenética es la encargada de posibilitar una buena organización de la cromatina en el núcleo celular, regulando la expresión génica en los distintos tejidos y tipos celulares, y manteniendo el patrón correcto de expresión en el momento y lugar adecuados.
Epigenética:
Un nuevo lenguaje. El ADN está molecularmente constituido por nucleótidos que, a su vez, están formados por un azúcar, una base nitrogenada y un fosfato. Es, precisamente, la base nitrogenada la que distingue un nucleótido de otro. Existen cuatro tipos de bases nitrogenadas en el ADN: la adenina (A), la guanina (G), la timina (T) y la citosina (C). El orden secuencial de estas moléculas en las regiones del genoma denominadas «codificantes» determina la naturaleza química de las proteínas que son codificadas por estos genes y, por lo tanto, su función. En las regiones del genoma denominadas «reguladoras» el orden de las bases nitrogenadas define con precisión cómo la maquinaria celular va a reconocer y procesar esta información. Necesariamente, para ser funcionales las moléculas de ADN deben someterse al proceso de «transcripción» por el que son copiadas fielmente a otra molécula con una naturaleza química similar, el ARN, o ácido ribonucleico. En este proceso juegan un papel relevante las secuencias reguladoras, es decir, conjuntos de nucleótidos que son reconocidos por la maquinaria celular o «factores de transcripción», de tal forma que se posibilita la formación de un complejo multiproteico que tras unirse físicamente al ADN comienza a copiarlo. La accesibilidad de las secuencias reguladoras determina la posibilidad de que se produzca el proceso de transcripción.
Impronta genómica y herencia epigenéticaImpronta genómicaLos procesos de metilación juegan un papel importante en la acción de la impronta genómica. En los vertebrados sólo se ha descubierto este mecanismo en los mamíferos. Según el origen parental los genes pueden ser activados o silenciados. La impronta afecta el crecimiento prenatal y se ha establecido su importancia en la generación de enfermedades. Durante la gametogénesis se inicia la impronta genómica y por lo tanto esta es heredada durante la fusión de los gametos. Durante la formación del cigoto la impronta es reprogramada en el nuevo individuo. El ejemplo más claro de este mecanismo se da en la regulación de la dosis compensatoria del cromosoma X. Esta reprogramación juega un papel importante en la expresión de los genes de tejidos específicos que si llegan a ser modificados pueden tener consecuencias en el desarrollo adecuado del organismo. Por lo tanto, con un mejor entendimiento de cómo ocurren estos procesos y como son regulados, se puede llegar a entender enfermedades como la preeclampsia, las pérdidas durante la gestación, los fallos que se dan en la reproducción asistida, los problemas asociados con la infertilidad y el cáncer entre otros.
Herencia epigenética
La herencia epigenética resulta de la transmisión de información que no depende de secuencias de las bases nitrogenadas del ADN a través de la meiosis o mitosis. La información epigenética modula, por tanto, la expresión de los genes sin alterar la secuencia de ADN. Los patrones de metilación de ADN son los mejores estudiados y entendidos como marcadores de fenómenos epigenéticos.
El epigenoma es la información epigenética global de un organismo.
Los tres principales tipos de información epigenética son:
- Metilación de la citosina del ADN: es un cambio en el ADN, en la que un grupo metilo es transferido desde S-adenosilmetionina a una posición C-5 de citosina por una ADN-5 metiltrasferasa. La metilación del ADN ocurre, casi exclusivamente, en dinucleótidos CpG, teniendo un importante papel en la regulación de la expresión del gen.
- Impronta genética: La impronta se manifiesta sólo en organismos superiores. Cuando hablamos de "imprinting", nos referimos a genes que pueden modificar su funcionamiento sin necesidad de un cambio en la secuencia del ADN. Este cambio en su forma de manifestarse que tienen los genes "imprintados" está generalmente ligado a su origen parental. Un gen imprintado se manifiesta de una manera cuando su origen es paterno y de otra cuando proviene del gameto materno. Parece ser que existe un mecanismo celular que de algún modo "marca" o deja una impronta sobre todos los genes "imprintables" de acuerdo al sexo del individuo.
- Modificación de histonas: incluye acetilación, metilación y fosforilación.
Sin embargo, al nombrar estos mecanismos, hay que recordar que "indirectamente", al analizar el origen de cada proceso en sí mismo, aún están involucrados los genes (como por ejemplo los genes de la enzima ADN-metiltransferasa, histonas, etcétera) y, por ende, también indirectamente están involucrados los cambios genéticos (como mutaciones) que puedan sufrir estos genes, o sobre los genes en que actúan. Del mismo modo, aunque las modificaciones epigenéticas no implican en el proceso un cambio en la secuencia de nucleótidos del ADN, sino que consisten en un cambio en la expresión de los genes, la selección natural igualmente, a partir del resultado biológico de dicha expresión de genes, actuará sobre el proceso epigenético y sobre el organismo que lo manifiesta.
Epigenética en el desarrollo y plasticidad fenotípica
Efectos dependientes de temperatura. La actividad enzimática depende de la temperatura, pues cambios en la temperatura pueden afectar a la manera en que las proteínas se pliegan, y por lo tanto afectar a su interacción con otros compuestos.7 Como el fenotipo depende de la actividad de muchas enzimas y de sus interacciones con proteínas en general, cambios en la temperatura pueden resultar en cambios en el fenotipo.
Mariposas: cambios en la coloración de las alas de acuerdo con la estación. Diversas especies de mariposas cambian su coloración de acuerdo con las estaciones. Los cambios en coloración tienen ventajas funcionales, y por esta razón han evolucionado.7 Usualmente, el fenotipo de los meses cálidos de verano tiene colores claros en las alas, mientras que el fenotipo de invierno muestra colores oscuros. Como los colores negros absorben la luz del sol de manera más eficiente, ayudan a aumentar la temperatura corporal durante el invierno; lo contrario ocurre durante el verano. Los cambios en coloración parecen estar controlados por la transducción de señales del ambiente al genoma a través del sistema neuroendocrino. Señales del ambiente, como temperatura y longitud del día, son percibidas por los sistemas neurosensoriales del organismo. Estos luego pueden activar o desactivar la secreción de hormonas por el sistema endocrino. Las hormonas, a su vez, pueden regular la expresión génica, ya que pueden activar factores de transcripción.
Las diferencias en la coloración de las alas de las mariposas en verano e invierno se dan por cambios en los niveles de la hormona ecdisona durante la etapa larval; las larvas que se desarrollan durante meses fríos están expuestas a niveles más bajos de ecdisona que las que se desarrollan en meses cálidos.
Reptiles y peces: determinación del sexo entre muchas especies de reptiles, tales como las tortugas y cocodrilos, e igualmente en algunos peces, el sexo de un organismo depende de la temperatura de desarrollo del embrión. Este mecanismo puede haber evolucionado en algunas especies para modificar la proporción 1:1 entre sexos. Por ejemplo, en cocodrilos, temperaturas altas producen más hembras, de manera que puede haber hasta 10 hembras por macho. Esto representa una ventaja para las especies en que el tamaño poblacional está limitado por el número de hembras.
En los peces, el sexo parece ser determinado por la relación entre dos hormonas: el estrógeno y la testosterona, relación que a su vez es controlada por la enzima aromatasa, que convierte la testosterona en estrógeno.7 La temperatura puede regular la aromatasa, y de esta manera determinar el sexo del organismo.
Efectos dependientes de la nutrición
La comida contiene señales químicas que pueden inducir cambios fenotípicos.
Abejas: la jalea real y la abeja reina. En las abejas, la producción de abejas reinas depende casi exclusivamente de la alimentación de las larvas. Las larvas que se alimentan de jalea real (que contiene altas concentraciones de proteínas y secreciones de las glándulas salivales de las abejas obreras) durante todo su desarrollo, serán abejas reinas con ovarios funcionales. Por el contrario, las larvas que son alimentadas con jalea real por cortos períodos de tiempo se convertirán en obreras sin ovarios funcionales. El consumo de jalea real causa altas tasas de síntesis de hormona juvenil (JH) en la larva. Esta hormona retrasa la metamorfosis, permitiendo que la larva se desarrolle durante más tiempo, adquiera un mayor tamaño, y desarrolle ovarios funcionales. Se ha demostrado que el cambio en los niveles de producción de JH está correlacionado con el silenciamiento del gen Dnmt3, que induce una reprogramación del transcriptoma larval. El silenciamiento de este gen se produce por alteración en los niveles de metilación, por lo que es claro que la regulación epigenética es un componente clave para controlar la división social de labores en la colonia.
Escarabajos: longitud de los cuernos. La calidad y cantidad de estiércol que reciben los escarabajos durante el desarrollo determina el fenotipo morfológico y comportamental de los escarabajos macho de algunas especies.15 Esto ocurre en especies como Onthophagus taurus y Onthophagus acuminatus, en las que los machos tienen cuernos y las hembras no. Como en las abejas, la hormona juvenil afecta el fenotipo, esta vez determinando la longitud de los cuernos de los machos. A mayores concentraciones de hormona juvenil, mayor longitud de los cuernos.
Variaciones en el fenotipo de machos de O. taurus dependientes de la alimentación durante el desarrolloComo los cuernos son un factor de selección sexual para la hembra, el comportamiento de los machos con cuernos cortos cambia para asegurar su reproducción. Mientras los machos con cuernos largos, que han sido escogidos por las hembras, cuidan la puerta de la guarida, los machos de cuernos cortos cavan túneles hasta llegar a donde se encuentra la hembra, para aparearse con ella evitando confrontación con el macho de cuernos largos. De esta manera, la alimentación deficiente causa bajos niveles de hormona juvenil, que a su vez resultan en machos de cuernos cortos con comportamiento “tramposo”.
Efectos de la presencia de predadores. Algunos organismos pueden detectar la presencia de moléculas secretadas por sus predadores y usarlas para activar el desarrollo de estructuras que los hagan menos susceptibles a la depredación. Existen muchos ejemplos de esta habilidad:
- El cladócero Daphnia produce una cabeza “en forma de casco puntiagudo”.
- El rotífero Keratella produce espinas adicionales.
- El balano Chthamalus cambia la posición de su apertura.
- El caracol Thais produce una concha más gruesa.
- Los renacuajos de la especie Agalychnis callidryas empiezan a salir de los huevos de manera temprana en respuesta a las vibraciones causadas por las serpientes.
Variaciones fenotípicas en Daphnia inducidas por la presencia de depredadores. Efectos de la presencia de miembros de la misma especie. Señales para cambiar el fenotipo también pueden venir de conespecíficos, o miembros de la misma especie, pues los individuos deben comportarse de maneras diferentes cuando están solos y cuando están rodeados de competidores. Usualmente las señales de depredadores y conespecíficos actúan de manera sinergística para producir el fenotipo más favorable.7 Algunos ejemplos se muestran a continuación:
- Las langostas Schistocerca gregaria muestran fenotipos muy distintos con bajas y altas densidades poblacionales. Cuando la densidad poblacional es alta y los recursos son poco abundantes, es beneficioso migrar. El fenotipo migratorio muestra colores más oscuros, alas más largas y comportamiento agresivo. Estos cambios son causadas por olores y contacto directo entre individuos.
- Peces de muchas especies cambian de sexo dependiendo de la interacción con conespecíficos. Por ejemplo, en los peces goby (Lythrypnus dalli), si el macho del grupo muere, una hembra puede tomar su lugar. Pero si se inserta otro macho de mayor tamaño en el grupo, el macho que se convirtió puede revertir su fenotipo a hembra.
La palabra biomarcador hace referencia a cualquier tipo de variación que ocurra en el material genético y por lo tanto es posible su detección en el organismo que porte dicho cambio. Los primeros marcadores utilizados se basan en los conceptos de la genética tradicional de tal forma que utilizaban sistemas polimórficos para detectar las variantes alélicas que llevaban a un cambio en el fenotipo. Para la detección de modificaciones epigenéticas se desarrollaron marcadores que se encargan de detectar moléculas que se relacionen con un estado particular de activación o inactivación de un gen. Por ejemplo, la detección de una alta cantidad de moléculas de metilo, indica un estado de inactivación del gen. Con la incorporación de técnicas moleculares, se crearon biomarcadores por medio de SNPs, indels, RFLPs y microsatélites entre otros. Para que un marcador sea considerado un buen marcador, éste debe requerir de una mínima cantidad de la muestra y debe permitir la identificación de diferencias significativas entre un estado normal y en un estado de cambios epigenéticos que pueden desarrollarse en una enfermedad. Basándose en esto, existe un tipo de marcadores que usan como muestra fluidos corporales y miden la concentración de ciertos metabolitos presentes, que se relacionan con cambios epigenéticos y más adelante en la formación de cáncer. Para la detección del cáncer, uno de los marcadores que se usa con mayor frecuencia son las modificaciones epigenéticas del promotor de los genes involucrados en la inhibición de kinasas, dependientes de ciclinas p15, p16 y RASSF1A. Estos sirven como marcadores de la detección de temprana de carcinomas hepatocelulares. Se toman muestras de sangre del paciente en el que se pueden detectar secuencias metiladas de los genes mencionados.
Generación de enfermedades
El conocimiento de estos fenómenos ha permitido que se den avances en terapias génicas. Se ha estado trabajando en revertir el silenciamiento de genes. Este trabajo se hizo en ratones con el síndrome de Rett que al ser tratados recuperaron su capacidad de producir niveles normales de la proteína MeCP2, disminuyendo así los signos de autismo que presentaban antes del tratamiento. Un factor clave en este campo es la heredabilidad de la marcación epigenética de una generación a otra, lo que permite aumentar el éxito de las terapias génicas. Si los cambios estructurales de la cromatina pueden ser determinados en gran medida por los factores ambientales y esto puede ser heredable, serían importantes en la expresión adaptativa según el ambiente. Estos últimos descubrimientos han llevado a considerar no sólo la expresión de los genes, sino también la menera en que dicha expresión puede ser modificada por factores ambientales.
La regulación epigenética se hace por medio de cambios estructurales, como es la adición de metilos, que pueden llevar a que se den alteraciones en los lugares de acción de enzimas, y como resultado, se pueden tener pérdidas en la estabilidad de dichas regiones. Por lo tanto, estas regiones se vuelven más sensibles a que en ellas se den variaciones cromosómicas o que se llegue a transformar la célula por pérdidas en el mecanismo de control de crecimiento o por activación de la apoptosis. Todo esto puede resultar en cambios en el fenotipo y una alta posibilidad del desarrollo de enfermedades.
Epigenética, cáncer y la señalización NOTCH. La epigenética del cáncer está proporcionando nuevas perspectivas acerca del cáncer. Hay dos claros ejemplos de modificaciones epigenéticas en células cancerígenas: - Se cree que la metilación del ADN es responsable del silenciamiento génico asociado con la impronta paterna, represión génica heterocromática y con la inactivación del cromosoma X. Las células cancerosas contienen patrones de metilación de ADN modificados, es decir, están mucho menos metiladas que las células normales. Además los promotores de genes en células cancerosas están hipermetilados. Por lo tanto, se cree que estas modificaciones hacen disminuir la represión de la transcripción sobre la mayoría de genes que estarían silenciados en las células normales. Estos perfiles de metilación se usan hoy en día para el diagnóstico de tumores. - Por otro lado, las modificaciones en las histonas , las cuales también se ven afectadas en células cancerosas.
Como se conoce que la ruta de señalización Notch está involucrada tanto en el desarrollo como en la renovación de tejidos, se ha planteado el papel ideal que juega la vía de transducción de NOTCH en la proliferación del cáncer. Recientemente se han desarrollado estudios en Drosophila que han permitido comprender mejor la relación de NOTCH y la formación de tumores. NOTCH es importante ya que tiene un papel en la determinación de destinos celulares, proliferación, apoptosis, diferenciación, migración y desarrollo celular. Con el estudio de drosophila se determinó que los receptores de Notch en los mamíferos y los ligandos de Delta están involucrados en la formación de tumores. Una activación aberrante del receptor NOTCH1 está relacionada con el 50% de los tipos de leucemia linfoblástica aguda de células T. Si se inactiva la vía de transducción de NOTCH se incrementa la formación de tumores, ya que se ha visto que en ciertos contextos Notch puede ser un supresor de tumores. Sin embargo, aún no se tiene un entendimiento claro de cómo in vivo Notch actúa en la formación del cáncer. Por esta razón los estudios se están enfocando en la identificación de los oncogenes y los supresores tumorales que interactúan con las vías de Notch. Con un mejor entendimiento de este tema y si se comprueba que los silenciamientos epigenéticos aumentan la formación de tumores, se pueden plantear terapias epigenéticas para combatir el cáncer.
La epigenética del cáncer es un área de investigación en curso que continúa facilitando la comprensión de la patogénesis molecular del cáncer y la identificación de nuevas alternativas terapéuticas.19 Estas investigaciones se han basado en el descubrimiento de biomarcadores que faciliten el diagnóstico y el conocimiento del cáncer; se ha encontrado que las enzimas ADN-metiltransferasa y histona-deacetilasa son muy efectivas en el diagnóstico del cáncer, y un conocimiento aún más específico acerca de ellas ayudaría a la supresión de tumores cancerígenos.
Posibles problemas con la reproducción asistida. Ya se ha mencionado que muchos de estos cambios son producto de la exposición al ambiente. En el caso de la reproducción asistida se ha generado la duda de si el tiempo de exposición al medio de cultivo puede implicar un efecto en los procesos de regulación epigenética. Dado que la etapa de desarrollo del embrión es un momento crítico en el cual se dan muchos cambios epigenéticos (como lo es una alta tasa de desmetilación para borrar las marcas epigenéticas de los parentales), el ambiente juega un papel importante hasta el punto que puede cambiar estos patrones. Durante la embriogénesis, después de borrarse la impronta de los padres, se forma un patrón de metilación de novo, el cual permite que se dé la diferenciación de tejidos. Si este proceso no se da de forma adecuada se pueden presentar enfermedades en el individuo o posibles problemas durante el embarazo que pueden llevar a la pérdida del embrión. Es por esto que se debe considerar que la exposición a un medio artificial puede llegar a tener un potencial toxicológico, impidiendo que se den los patrones de regulación adecuados. Aunque un gran porcentaje de niños nacidos por esta técnica presentan un desarrollo y crecimiento normal, se ha observado que hay una tendencia a que presenten un bajo peso al nacer y que existe un aumento de tres a seis veces en la ocurrencia de los síndromes Beckwith-Wiedemann y Angelman. Aún no hay un conocimiento claro en los humanos de cómo los distintos factores de la fecundación in vitro donde se forman los embriones, puedan tener o tengan un efecto importante en el desarrollo de los mismos. En embriones de ratón sí se han observado cambios en la impronta epigenética.
THE ROLE OF REVERSE TRANSCRIPTASE (RTE)-LIKE AND OTHER NON-LTR RETROTRANSPOSONS IN THE RESPONSE OF SHRIMP TO IHHNV, WSSV, TSV AND IMNV INFECTIONS
|